| |
| Med Sci (Paris). 2006 May; 22(5): 493–501. Published online 2006 May 15. doi: 10.1051/medsci/2006225493.
Urbilateria, un être évolué ? Jean-Pierre Cornec* and André Gilles* EA 3781 EGEE (évolution, génome, environnement). Université de Provence, Aix-Marseille I, Centre St-Charles, case 36, 3, place Victor-Hugo, 13331 Marseille, France |
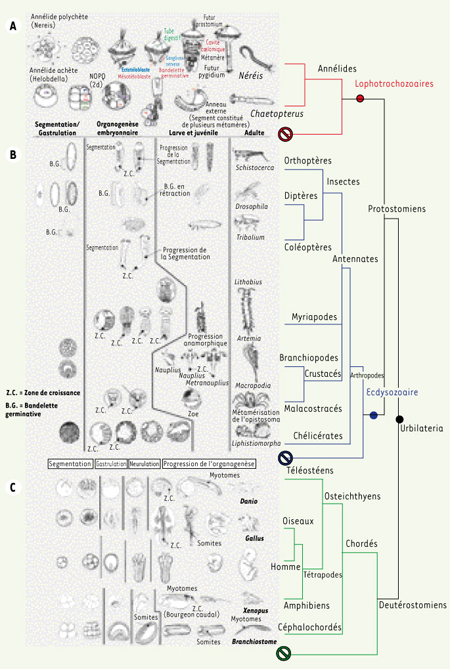
Segmentation du corps : aspects morpho-anatomiques et embryologiques Annélides, arthropodes et chordés présentent trois aspects de l’organisation segmentaire. Annélides et arthropodes sont des protostomiens*1, tandis que les chordés sont des deutérostomiens*. Chez les annélides et les arthropodes, la segmentation concerne la globalité du corps, les motifs répétés sont des métamères, segmentation et métamérisation sont synonymes. Les métamères annélidiens, tels qu’ils apparaissent chez la Néréis (annélide polychète), sont des unités morpho-anatomo-fonctionnelles intégrées, délimitées par des cloisons internes ou dissépiments et, extérieurement, par des sillons creusés dans l’épiderme (annélation externe). Leur architecture de base (myomère, neuromère, néphromère et angiomère)* est fondamentalement organisée autour d’une paire de cavités cœlomiques, lesquelles en représentent la marque distinctive, la signature structurale. Chez les arthropodes, les limites segmentaires s’estompent en partie en raison de processus de fusion liés à la tagmatisation*, particulièrement au niveau de la région céphalique. La cavité générale n’est pas un cœlome, mais un hémocœle rempli d’hémolymphe. Les preuves d’une métamérisation sont à rechercher dans la disposition répétée des paires de ganglions de la chaîne nerveuse et dans la présence d’appendices articulés. Quant aux chordés, ils ne sont pas métamérisés au sens strict du terme ; la réalité d’une organisation segmentaire doit être recherchée dans l’itération de structures internes : nerfs, myotomes et vertèbres. Ces trois tendances sont-elles apparues indépendamment, ou un lien peut-il être établi entre elles ? En d’autres termes, les organisations segmentaires de ces trois groupes de métazoaires sont-elles ou non homologues ? L’analyse des étapes de l’ontogenèse dans ces trois groupes apporte des informations (Figure 1).  | Figure 1.
É
tapes de l’ontogenèse. A. Chez les annélides, le clivage de l’œuf est spiral. La détermination des territoires, précoce, s’établit dès le stade 64. Les blastomères 2d (premier somatoblaste) et 4d (deuxième somatoblaste) jouent un rôle marquant dans la suite du développement. Le blastomère 2d a une destinée ectodermique, le second est l’initiale mésodermique. Leur devenir, bien connu sous ses aspects descriptifs chez la Néreis, associé au développement de la larve trocophore, a été analysé de façon fine, jusqu’au plan génétique, chez les clitellates, dont le développement est direct, les hirudinées (achètes) Helobdella stagnalis, Theromyzon rude et tessulatum [17] et l’oligochète Tubifex [18], notamment. Au-delà de différences dans les modalités de la gastrulation entre les polychètes et les clitellates, les mouvements et les divisions de ces blastomères conduisent, dans les deux cas, à la mise en place de cellules de grande taille, les téloblastes. Regroupés dans la région postérodorsale de l’embryon (chez les clitellates) ou postéroventrale chez la jeune trocophore (polychètes), les téloblastes se répartissent en deux populations disposées bilatéralement par rapport au tube digestif : les ectotéloblastes (ETB), en position superficielle, et les mésotéloblastes (MTB), en position sous-jacente, profonde. Chez les polychètes comme chez les clitellates, les divisions des téloblastes, inégales, conduisent à la mise en place de bandelettes germinatives qui s’allongent en direction antérieure : bandelettes ectodermiques et mésodermiques chez les clitellates, mésodermiques chez les polychètes. La segmentation des bandelettes est le point de départ de la métamérisation. Chez les polychètes, elle s’accompagne du creusement des cavités cœlomiques (schizocœlie), un processus qui progresse antéropostérieurement ; l’annélation externe en est généralement la conséquence. La somatopleure s’applique étroitement contre l’ectoderme qui se moule sur elle ; les sillons intersegmentaires superficiels correspondent exactement aux plans séparant les paires successives de sacs cœlomiques. B. De l’œuf à l’adulte : les étapes du développement des arthropodes. C. Les poissons et les oiseaux ont des œufs riches en vitellus, dont le clivage est méroblastique. La blastula qui en dérive est une discoblastula, au sein de laquelle le blastoderme constitue un massif cellulaire localisé à l’apex de la masse vitelline indivise. Chez les poissons, la gastrulation combine une prolifération polaire, qui entraîne un recouvrement progressif de la masse vitelline, et une involution du matériel organogène sur les bords du front de migration. Chez les oiseaux, la périphérie du blastoderme est soudée au vitellus, et le passage en profondeur des territoires mésodermiques et endodermiques se réalise, après convergence par immigration à partir d’une lignée primitive, blastopore allongé, individualisé dans l’axe de la zone pellucide, entre 12 et 16 heures d’incubation chez la poule. Le caractère hétérolécithe de l’œuf de xénope, amphibien anoure, entraîne des modalités différentes : un clivage holoblastique inégal, une gastrulation par convergence, extension et involution au niveau du blastopore annulaire localisé dans la partie postérodorsale de l’embryon. Les sens interdits indiquent l’existence d’embranchements non métamérisés. |
Annélides et arthropodes Chez les annélides, les mésotéloblastes à partir desquels s’édifient les bandelettes germinatives sont des cellules souches qui s’autogénèrent. Leur localisation définit une zone de croissance prépygidiale dont l’activité, maintenue au cours du développement et chez les adultes (sauf chez les Hirudinés, qui ont un nombre fixe de métamères), met en place les métamères postérieurs. Les insectes ont des œufs à vitellus abondant (œufs télolécithes) occupant une position centrale (œufs centrolécithes). Le clivage n’intéresse que les noyaux (clivage partiel ou méroblastique*) qui se portent à la périphérie pour constituer un blastoderme syncytial, puis cellulaire, ou d’emblée cellulaire ; à ce stade, les territoires embryonnaire et extra-embryonnaire sont déterminés. Le premier, qui occupe une position ventrolatérale, constitue la bandelette germinative. La carte des territoires présomptifs place le mésoderme en position ventrale, avec de part et d’autre l’ectoneuroderme. L’importance de cette bandelette et les modalités de son évolution séparent la drosophile de tous les autres insectes étudiés. La drosophile est un insecte à bandelette germinative de grande taille. Pendant que le mésoderme s’internalise par invagination médioventrale, la bandelette germinative subit une phase d’élongation qui l’entraîne dorsalement, puis une phase de rétraction qui la ramène ventralement. C’est au cours de la phase d’extension maximale que se manifestent les premiers signes morphologiques de la segmentation du corps. Des constrictions tégumentaires délimitent des parasegments, formations transitoires décalées par rapport aux segments, qui s’individualisent définitivement lors de la phase de rétraction de la bandelette et à l’éclosion. L’embryon, puis la larve, sont alors formés de 6 segments céphaliques, 3 segments thoraciques et 8 à 9 segments abdominaux. Toutes les unités métamérisées apparaissent donc simultanément pendant, ou juste après, la gastrulation [
2,
3]. Ce mode de segmentation n’est pas généralisable aux autres insectes. Chez les odonates, certains orthoptères [ 2, 3] et chez le coléoptère Tribolium castaneum [
4,
5], la bandelette germinative est réduite, ou de taille intermédiaire ; sa segmentation conduit à la mise en place des métamères antérieurs uniquement. Les autres métamères sont formés, de façon séquentielle, selon une progression antéropostérieure, à partir d’une zone de croissance. Ce processus, contrairement à celui de la drosophile, considéré actuellement comme très dérivé, se rapproche de celui des annélides. Dans tous les cas, les blocs métamériques individualisés se creusent d’un cœlome mais, rapidement, les limites segmentaires se désagrègent, la cavité cœlomique conflue dans la cavité blastocœlienne* et l’ensemble forme un hémocœle. L’ontogenèse des arthropodes autres que les insectes a fait l’objet d’études morphologiques plus ou moins approfondies. Le mode de segmentation des myriapodes se réalise de façon différente selon les groupes. Chez les scutigéromorphes et les lithobiomorphes, le développement est anamorphique, alors qu’il est épimorphique chez les scolopendromorphes et les géophilomorphes [3]. Chez les premiers, la mise en place du nombre définitif de segments se poursuit au cours de mues qui suivent l’éclosion tandis que, chez les seconds, le nombre total de segments est atteint dès la phase embryonnaire. Chez Lithobius atkensoni, une zone de croissance a été signalée [
6]. On peut généraliser aux crustacés. Le clivage de leurs œufs est, selon la richesse en vitellus, totale, inégale ou partielle et superficielle. Ces deux types coexistent chez les malacostracés*, aussi bien que chez les autres crustacés. Anamorphose et épimorphose sont également impliquées dans la progression de la segmentation. Les non-malacostracés éclosent au stade nauplius, tandis que les malacostracés, à l’exception des euphausiacés et des pénéides, éclosent à un stade plus avancé. Chez les premiers, et notamment chez Artemia franciscana, la larve porte trois paires d’appendices (antennules, antennes et mandibules) correspondant aux segments dits naupliens, les autres ébauches se formant ultérieurement, au cours de plusieurs stades métanaupliens à partir d’une zone de bourgeonnement pré-anale [
7]. Chez les malacostracés, le stade nauplien est intra-ovulaire, mais les segments naupliens se mettent d’abord en place, simultanément, puis les bourgeons des autres segments apparaissent. Ils se forment, là encore, à partir d’une zone de croissance qui apparaît dans la partie terminale de la bandelette germinative caractéristique des malacostracés à développement méroblastique [
8]. Chez les chélicérates, à l’exception des scorpions, la segmentation conduit à une périblastula. L’étape marquante du développement est la formation d’une bandelette germinative qui s’accroît et se segmente. Les études relativement anciennes [
9] décrivent un mécanisme en deux étapes. La première est caractérisée par une fragmentation de la bandelette réalisée en une seule fois : trois territoires sont ainsi créés chez le scorpion, alors que l’on en dénombre quatre ou plus chez les aranéides. Les territoires extrêmes correspondant aux extrémités céphalique et caudale de la bandelette sont, dans tous les cas, des macrosomites qui se subdivisent au cours de la deuxième étape, pour individualiser les métamères définitifs. Le développement embryonnaire de l’araignée Cupiennius salei a pu être comparé à celui des insectes à bandelette germinative réduite [
10], et les figures proposées montrent clairement que la segmentation de la région opisthosomale progresse d’un stade à l’autre sans que puisse être précisé si l’addition de métamères est le fait d’une mérosegmentation tardive ou d’un bourgeonnement à partir d’une zone de croissance. La présence d’une zone de croissance postérieure impliquée dans la production des segments a été mentionnée chez Euscorpius flavicaudis [
11]. Chordés Comment la segmentation progresse-t-elle chez les chordés ? Le mésoderme en est le support histologique. La fragmentation est limitée à sa région dorsolatérale, et concerne le mésoderme somitique paraxial. Les somites sont les motifs répétés des chordés. La partie latéroventrale, au sein de laquelle se creuse le cœlome, demeure indivise. Le mésoderme somitique involué au cours de la gastrulation est à l’origine des somites les plus antérieurs, les douze premiers chez les poissons et les amphibiens [
12,
13], de 13 à 16 chez les oiseaux, nombre de somites quantifié lorsque la ligne primitive a totalement régressé [
14]. Par quel mécanisme les somites postérieurs sont-ils mis en place ? Le sujet fait encore l’objet d’un débat. Des expériences de marquage utilisant des traceurs fluorescents ont révélé la présence, en fin de gastrulation, d’une zone particulière, le bourgeon caudal, au niveau de laquelle se localise un massif cellulaire rassemblant la dernière partie du territoire présomptif somitique. Pour certains auteurs (pour revue, voir [ 14]), les mouvements de la gastrulation se poursuivraient dans le bourgeon caudal ; le processus de mise en place serait alors identique à celui qui conduit à l’individualisation des somites antérieurs. D’autres auteurs, en revanche, attribuent aux cellules du bourgeon caudal un caractère multipotent, et assimilent cette région de l’embryon à une zone germinative, zone de croissance [
15,
16]. La mise en place des somites, dans ces conditions, relèverait d’un mécanisme comparable à celui des métazoaires protostomiens. |
Segmentation du corps : aspects moléculaires et génétiques La segmentation est déterminée génétiquement. La cascade des gènes mis en activité a été décryptée chez la drosophile (Lewis, Nüsslein-Volhard, Wieckhaus, Prix Nobel 1995) : gènes de polarisation antéropostérieure et dorsoventrale, gènes de segmentation (gènes Gap, pair-rule et de polarité segmentaire), gènes homéotiques. Leurs orthologues* ont été identifiés dans les différents taxa de métazoaires. Les relations d’homologie ont été testées par différents auteurs à l’aide de reconstructions phylogénétiques [
19]. Une analyse comparée de leur expression a pu être tentée. Le gène caudal de la drosophile joue un rôle crucial dans la spécification de la région postérieure du corps (gène de polarité, gène postériorisant). Les profils d’expression de ses orthologues ont été établis, par hybridation in situ et immunocytochimie, chez le coléoptère Tribolium castaneum [4], le criquet Schistocerca gregaria [
20] et le crustacé branchiopode Artemia franciscana [7]. Tc-Cad s’exprime uniformément dans le blastoderme dans un premier temps, puis se concentre dans la zone de croissance postérieure où la protéine se répartit en gradient postéro-antérieur. L’expression persiste jusqu’à ce que la segmentation soit complète. Chez Artemia, l’expression de Af-Cad est d’emblée restreinte à la zone de croissance et se répartit uniformément. L’invalidation du gène par ARN interférence conduit à l’obtention d’embryons tronqués dépourvus, chez le coléoptère, des segments thoraciques et abdominaux et, chez le crustacé, des segments thoraciques postérieurs, génitaux et post-génitaux, confirmant ainsi l’implication de caudal dans la mise en place de la région postérieure. Ces résultats ont été étendus aux myriapodes [
21], ainsi qu’aux vertébrés. Chez ces derniers, en effet, le gène Cdx, homologue de Cad, s’exprime dans la zone correspondant au bourgeon caudal et renfermant le mésoderme présomitique [
22]. Les gènes pair-rule sont les marqueurs des segments individualisés. Des orthologues des gènes de drosophile ont été découverts chez les annélides, les arthropodes autres que la drosophile et les vertébrés. L’expression des orthologues du gène Hairy, analysée chez Tribolium castaneum [
23,
24], l’araignée Cupiennius [
25] et le poisson zèbre (gène her-1) [
26], est conforme au patron périodique décrit chez la drosophile. Dans les trois cas, elle s’installe progressivement, selon une vague antéropostérieure qui émerge de la zone de prolifération postérieure ou, chez les vertébrés, du bourgeon caudal. Les gènes de polarité segmentaire de la drosophile, engrailed et wingless, établissent et stabilisent les limites segmentaires. Ils s’expriment dans les cellules situées de part et d’autre de celles-ci (Figure 2). Les profils spatiotemporels d’expression de leurs orthologues sont connus. Si, dans certains cas (hirudiné, polychète chaetoptère), l’expression, tardive, ne peut pas être associée à la segmentation, dans d’autres, la relation a pu être clairement établie et le schéma d’expression est alors conforme à celui de la drosophile : c’est le cas de l’annélide Platynereis dumerillii [
27], de Tribolium castaneum [23] et de l’araignée Cupiennius salei [10], mais également d’Amphioxus, un céphalochordé. Outre engrailed et wingless, un troisième gène impliqué dans la polarité segmentaire a pu être identifié : le gène hedgehog. Le maintien des limites segmentaires repose sur des interactions réciproques entre cellules adjacentes via les messagers à rayon d’action local que sont la protéine hedgehog, sécrétée par les cellules exprimant engrailed, et la protéine wingless (Figure 2). Les homologues de hedgehog ont été isolés et leur expression étudiée chez l’hirudiné Helobdella robusta [
28], les insectes Schistocerca [
18] et Gryllus bimaculatus [
29], le myriapode Glomeris marginata [
30], le crustacé Artemia salina, le chélicérate Euscorpius flavicaudis [11], les procordés Amphioxus [
31] et Ciona [
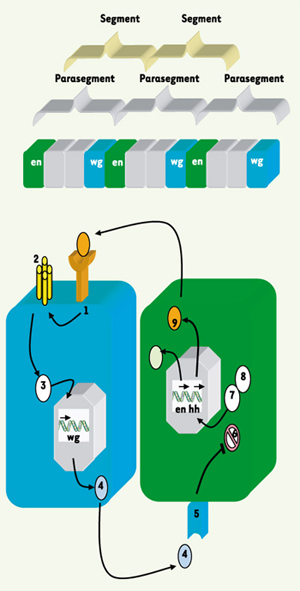
32], ainsi que chez les vertébrés. L’expression précoce, dans beaucoup de cas, a pu être associée à la segmentation, comme elle l’est chez la drosophile. La transduction du signal wingless déclenche une voie complexe dans laquelle est impliquée la protéine Armadillo, un facteur de transcription, homologue de la β caténine des vertébrés. Un homologue d’Armadillo a été isolé chez Gryllus bimaculatus (Gb Arm), dont le profil d’expression se superpose à celui de hedgehog.  | Figure 2.
É
tablissement et stabilisation des limites segmentaires chez la drosophile, par les gènes de polarité segmentaire engrailed (en) et wingless (wg). En l’absence de wingless (wg ➃), le facteur de transcription Armadillo (➆) est phosphorylé par une kinase codée par le gène Zest-White 3 (➅), homologue de la GSK (glycogène synthétase kinase 3) des vertébrés. Sous cette forme, il est adressé au protéasome, puis dégradé. En revanche, l’interaction entre wingless et son récepteur, la protéine codée par le gène frizzled (➄), réprime la kinase, libère Armadillo, qui migre dans le noyau et active, en coopération avec le facteur codé par le gène pangolin (➇), la transcription de gènes cibles, dont le gène hedgehog (hh), sa protéine (➈) et la voie de signalisation qu’elle initie : patched (➀), smoothened (➁) et cubitus interruptus (➂). |
Les gènes homéotiques spécifient l’identité segmentaire le long de l’axe antéropostérieur. Chez la drosophile, ils sont rassemblés en deux complexes, ou clusters, Antennapedia (5 gènes) et Bithorax (3 gènes). Le premier contrôle la région céphalique et les deux premiers métamères thoraciques, tandis que le second contrôle le reste du corps. Des orthologues, les gènes Hox, ont été détectés chez la plupart des eumétazoaires. Deux faits majeurs sous-tendent l’évolution de certains d’entre eux, des duplications à l’origine de paralogues* et de groupes de paralogie, d’une part, et un changement de fonction se traduisant par des profils d’expression différents d’un métazoaire à un autre, d’autre part. Un exemple significatif est celui du gène Hox 3 : initialement identifié chez les vertébrés, ses homologues ont été découverts, puis clonés, chez les annélides et les arthropodes, à l’exception de la drosophile où la séquence correspondante est celle du gène Zerknüllt (Zen). Hox 3 fait partie du groupe de paralogie III Hox3/Zen ; chez les arthropodes autres que les insectes, l’araignée et la mite, son domaine d’expression est conforme à celui d’un gène d’identité segmentaire [10]. Chez les insectes, en revanche, il s’exprime dans les tissus extra-embryonnaires. Il a donc changé de fonction au cours de l’évolution des arthropodes. Parmi les annélides, le polychète chaetoptère est un modèle intéressant. Un gène, membre de chacun des cinq premiers groupes de paralogie (CH-Hox 1 à CH-Hox 5), a pu être identifié et ses profils d’expression établis [
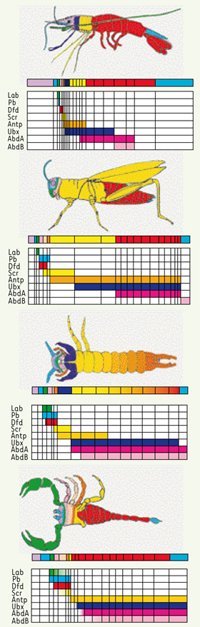
33]. Les gènes s’expriment de façon précoce dans les cellules de la zone de croissance prépygydiale, avant que les segments ne s’individualisent. Leur activité est mise en jeu séquentiellement, de Hox 1 à Hox 5. Une expression tardive est détectable dans les métamères formés ; elle suit la règle de colinéarité spatiale, avec frontière antérieure d’expression décalée d’un gène à un autre et d’un métamère à un autre. Des homologues de chacun des huit gènes traditionnels de drosophile ont été identifiés chez tous les arthropodes ; ils offrent un profil d’expression assez semblable (Figure 3). Cette observation est importante, car elle fournit les arguments permettant d’établir de manière irréfutable les homologies segmentaires au sein du groupe des arthropodes.  | Figure 3.
Profil d’expression des gènes Hox chez quatre représentants symboliques des arthropodes. La barre du haut représente les homologies morphologiques, les huit barres groupées du bas représentent les patrons d’expression des huit gènes homéotiques. Le gène labial est actif chez les insectes ( Drosophila, Tribolium et Thermobia domestica) dans le segment intercalaire, celui qui correspond au troisième métamère céphalique et qui renferme le tritocérébron. Il s’exprime chez Porcellio scaber, dans le segment porteur de la deuxième paire d’antennes, et chez l’araignée Cupiennius, dans celui qui supporte les pédipalpes [ 16]. Cela est un argument en faveur d’une homologie de ces segments et remet en question le fait, longtemps admis, que le segment chélicérien est celui qui renferme le tritocérébron [
34]. Le gène deformed s’exprime dans les segments mandibulaires et maxillaires de tous les insectes testés. Le patron, en revanche, est réduit chez les crustacés, et plus étendu chez les centipèdes et les chélicérates. Chez ces derniers, qui représentent l’état ancestral, l’activité est détectable dans tous les segments porteurs de pattes. Le gène sex-comb reduced s’exprime sur deux ou trois segments, de la partie postérieure de la région céphalique à la partie antérieure du thorax. Chez les insectes, la limite postérieure se situe donc au niveau du prothorax avec de légères différences quant à la surface du domaine qui, sauf chez la drosophile, se réduit à un ou deux spots. Chez Porcellio, les métamères spécifiés sont, respectivement, ceux porteurs des maxillules, des maxilles et des maxillipèdes. Le gène antennapedia s’exprime fortement dans les segments thoraciques des insectes et des crustacés. Chez Tribolium, l’homologue est le gène prothorax less. Le phénotype mutant se caractérise par la transformation en antennes des trois paires de pattes thoraciques. Lithobius et l’araignée se démarquent du schéma général. Chez le premier, l’expression est fluctuante, étendue initialement à tout le tronc pour se limiter ensuite aux quatre premiers segments flanqués de pattes. Cela tient vraisemblablement au caractère homonome de la métamérie et à l’absence de subdivision du tronc en thorax et abdomen. Chez l’araignée, l’activité recouvre la totalité de l’opisthosoma. Le patron d’expression d’ ultrabithorax reflète, chez la drosophile et les autres insectes, son rôle clef dans la spécification des métamères abdominaux. Ainsi, chez Tribolium, l’inactivation par ARNi de l’homologue ultrathorax ( Utx), conduit à des larves qui développent des pattes sur les métamères A1 à A8. Chez le centipède Lithobius, le domaine d’expression s’étend à la totalité du tronc en rapport avec le caractère homonome de cette partie du corps, et la frontière antérieure se situe au niveau du premier métamère porteur d’appendices locomoteurs, donc en arrière de celui qui supporte les forcipules que l’on peut homologuer à des maxillipèdes. Chez Cupiennius, le gène s’exprime dans l’opisthosoma à partir de Op2 [ 16,
35] et ce patron d’expression a été retrouvé chez le scorpion Paruroctonus et la limule, considérés comme des chélicérates primitifs. Le patron d’expression d’ Abd-A est conservé chez tous les arthropodes étudiés. Le domaine se situe au niveau de l’abdomen des insectes, le pléon chez le crustacé Porcellio, le tronc des centipèdes et l’opisthosoma de l’araignée. Il correspond à celui de Ubx avec un décalage de la frontière antérieure. Il spécifie donc, comme Ubx, l’identité abdominale. Chez les insectes, sa limite postérieure est fonction de la longueur de l’abdomen, plus exactement du nombre de métamères, lequel varie de 10 à 11 ( Tribolium, Schistocerca, Thermobia), à 8 bien développés ( Drosophila). Chez Tribolium, par exemple, Abd-A est actif dans tous les métamères abdominaux (de A1 à A10) ; chez la drosophile, il s’étend de la partie postérieure de A1 à la partie antérieure de A8. Le domaine d’expression d’ Abd-B, dans la majorité des cas, se restreint à la partie postérieure du corps de l’embryon dans les métamères où, généralement, se différencient les appendices génitaux ou génitalia. Ainsi est-il considéré comme le gène promoteur des génitalia. Une analyse fine tend à confirmer ce point de vue. Chez Artemia, l’activité de Abd-B n’est pas détectable à l’extrémité de l’abdomen, mais en arrière du thorax, dans les segments génitaux. Chez Cupiennius, deux spots d’expression s’observent, en plus, dans les primordia des pores génitaux, dans le segment Op2. |
|
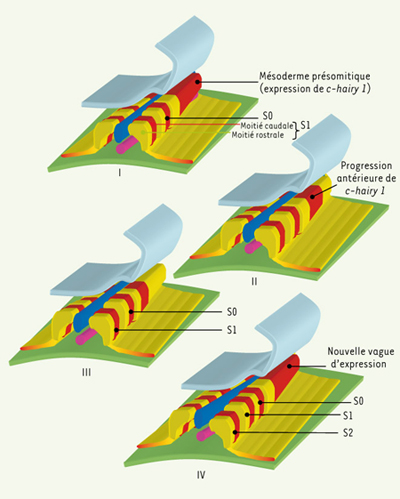
La segmentation des vertébrés répond-elle aux mêmes critères génétiques ? Organisés en quatre groupes de paralogie chez les tétrapodes (mais huit chez les téléostéens), les gènes Hox ont fait l’objet d’analyses poussées chez le poulet et la souris. Leur implication dans l’organisation régionale du système nerveux [34], des somites et des vertèbres [35] est nettement corrélée à leurs domaines d’expression, lesquels suivent les mêmes règles que chez la drosophile. L’analyse de la somitogenèse chez le poulet a révélé un aspect jusqu’alors inédit de la segmentation : les paires de somites s’individualisent selon un rythme précis, toutes les 90 minutes, à partir du mésoderme présomitique (Figure 4). Elle suppose l’existence d’un oscillateur qui règle, à la manière d’une horloge, la programmation de la segmentation [14]. Le concept d’horloge de la segmentation a ensuite été élargi à d’autres vertébrés comme le poisson zèbre, le xénope ou encore la souris : chez cette dernière, la période du rythme est de 90 à 120 minutes. 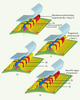 | Figure 4.
Somitogenèse chez le poulet : profil d’expression du gène C-Hairy 1 (concept d’horloge de la segmentation). La rythmicité de la somitogenèse chez le poulet repose, au niveau génétique, sur un profil d’expression spatiotemporel original du gène C-hairy 1, homologue du gène pair-rule hairy de drosophile : des vagues d’ARNm progressent périodiquement en direction antérieure, puis s’amenuisent pour, finalement, se stabiliser dans la partie caudale du somite nouvellement formé. |
L’existence d’un tel mécanisme soulève deux questions : quelle est la nature moléculaire de l’oscillateur ? Quelle est, ou quelles sont, les voies de signalisation mise(s) en jeu ? L’examen de phénotypes mutants obtenus par invalidation chez le poisson zèbre ou la souris a démontré le rôle clef joué par la voie de signalisation Notch1/delta1 (Dll1). La cible de cette voie est le gène Lunatic fringe (Lfng), qui oscille de façon synchrone avec hairy 1 dans le mésosderme présomitique. Chez la souris, une autre composante de l’oscillateur a pour support la voie de signalisation initiée par Wnt3a (voie Wnt/β-caténine) et pour cible le gène de l’axine 2 [16]. Les ARNm de l’axine 2 s’accumulent et sont dégradés de façon cyclique dans le bourgeon caudal. Une analyse approfondie a révélé que l’expression des deux cibles oscillait de façon alternative ; un modèle d’interaction entre les deux voies de signalisation, reposant sur un mécanisme on-off (Wnt_on-Notch_off, Wnt_off-Notch_on), a pu être proposé [16]. Ce processus de segmentation a fourni à certains auteurs un argument de poids pour réfuter l’hypothèse d’une origine commune de la segmentation chez les métazoaires. Certains résultats, pourtant, sont susceptibles de relancer le débat. Les gènes Notch, Delta, et Wingless (homologue de Wnt) s’expriment dans la zone de croissance de l’araignée [24,
37], de Lithobius [6], du crustacé Triops [
38] et des hirudinés [
39]. |
Les données morpho-anatomiques et embryologiques soulignent le caractère assez général des modalités de la segmentation chez les protostomiens et les deutérostomiens. Le processus de mise en place des segments en deux temps avec, après la gastrulation, l’intervention d’une zone de prolifération et de différenciation, peut être considéré, sous réserve d’informations complémentaires concernant les vertébrés, comme le processus ancestral, le processus plésiomorphe. L’extension du corps à partir d’une zone générative postérieure semble être un phénomène développemental assez fréquent : il répond au concept d’addition terminale évoqué par de nombreux auteurs [
40]. Au-delà de quelques différences, reflets d’une certaine variabilité, la segmentation du corps est déterminée par les mêmes catégories de gènes homologues, qui s’expriment selon des patrons comparables et contrôlent ou mettent en jeu des voies de signalisation similaires. La zone de croissance postérieure des protostomiens, comme le bourgeon caudal des vertébrés, sont les sites d’expression initiale des gènes et ceux à partir desquels les profils s’établissent et se maintiennent en même temps que les métamères s’individualisent selon une progression antéropostérieure. La synthèse des données actuelles et la congruence des résultats émanant de recherches menées à différentes échelles d’étude constituent un faisceau de preuves suffisamment étoffé pour concevoir comme réaliste une structure segmentée pour l’ancêtre commun des bilatériens. L’inférer de façon définitive est prématuré, et ne sera possible que lorsque des données embryologiques et génétiques substantielles permettront d’interpréter les traits marquants de l’organisation de certains groupes de métazoaires qui posent encore un problème : plathelminthes (acœlomates*), kinorhynques (pseudo-cœlomates*), mollusques et deutérostomiens épithélioneuriens* (échinodermes, hémicordés). Les uns et les autres sont structurés selon le mode itératif : commissures nerveuses* des plathelminthes, cœlome des épithélioneuriens subdivisé en trois compartiments (trimérie), plaques ambulacraires* des échinodermes, par exemple. Un lien peut-il être établi avec l’organisation segmentaire précédemment décrite ? Certaines informations le laissent entrevoir. Le caractère acœlomate des plathelminthes doit être reconsidéré. En effet, le triblastique le plus ancien actuellement connu, Vernanimalcula guizhouena, extrait des gisements de phosphates de Doushantuo datant de 600 millions d’années, a un cœlome développé [
41] : l’état cœlomate semble donc primitif, et l’état acœlomate dérivé. L’itération observée chez les plathelminthes actuels peut alors s’inscrire dans le schéma de la segmentation et être considérée soit comme une étape d’un processus inachevé, soit comme le vestige d’un processus altéré. Les échinodermes adultes ont une symétrie radiaire, mais des gènes Hox ont été identifiés, qui s’expriment dans le mésoderme, plus précisément dans le troisième compartiment cœlomique, ou somitocœle [
42]. La trimérie cœlomique repose donc sur des fondements génétiques comparables à celles des métazoaires segmentés. Et la similitude peut être poussée plus loin : la mise en place des plaques ambulacraires au cours de la croissance post-métamorphique des échinides dépend d’un mécanisme d’addition terminale à partir d’une zone de croissance [
43]… autant de faits qui autorisent à envisager la segmentation comme un des caractères unificateurs des plans d’organisation des métazoaires. Comprendre et généraliser les mécanismes de segmentation, c’est-à-dire démontrer l’homologie de la métamérie au sein des métazoaires, devrait permettre de mieux cibler les voies de régulation qui sont contraintes au cours de l’évolution, et extraire ainsi la spécificité de l’interactome de l’homme. L’analyse comparative et la confrontation des données embryologiques et génétiques sont les deux axes de recherche susceptibles d’atteindre ce but, et de décrypter ces deux aspects.

|
Footnotes |
1. Baguna J, Riutort M. The dawn of bilaterian animals : the case of acoelomorph flatworms. Bioessays 2004; 26 : 1046–57 2. Minelli A, Fusco G. Evo-devo perspectives on segmentation : model organisms and beyond. Trends Ecol Evol 2004; 19 : 423–29. 3. Davis GK, Patel NH. Short, long and beyond : molecular and embryological approaches to insect segmentation. Ann Rev Entomol 2002; 47 : 669–99. 4. Schulz C, Schroder R, Hausdorf B, et al. A caudal homologue in the short germ band beetle Tribolium shows similarities to both the Drosophila and the vertebrate caudal expression patterns. Dev Genes Evol 1998; 208 : 283–89. 5. Schroder R, Eckert C, Wolff C, Tautz D. Conserved and divergent aspects of terminal patterning in the beetle Tribolium castaneum. Proc Natl Acad Sci USA 2000; 97 : 6591–6. 6. Hughes CL, Kaufman TC. Hox genes and the evolution of the arthropod body plan. Evol Dev 2002; 4 : 459–99. 7. Copf T, Rabet N, Celniker S, Averof M. Posterior patterning genes and identification of a unique body region in the brine shrimp Artemia franciscana. Development 2004; 130 : 5915–27. 8. Grassé PP. Traité de zoologie : anatomie, systématique, biologie. Crustacés, tome VII, fascicule I. Paris : Masson, 1994 : 918 p. 9. Grassé PP. Traité
de zoologie : anatomie, systématique, biologie. Chélicérates, tome VI, fascicule I. Paris : Masson, 1949 : 980 p. 10. Damen WGM, Tautz D. A Hox class 3 orthologue from the spider Cupiennius salei is expressed in a Hox-gene like fashion. Dev Genes Evol 1998; 208 : 586–90. 11. Simonnet F, Deutsch J, Queinnec E. Hedgehog is a segment polarity gene in a crustacean and a chelicerate. Dev Genes Evol 2004; 214 : 537–45 12. Kanki JP, Ho RK. The development of the posterior body in zebrafish. Development, 1997; 124 : 881–93. 13. Keller R. The origin and morphogenesis of amphibian somites. Curr Top Dev Biol 2000; 47 : 183–246 14. Pourquie O. Vertebrate somitogenesis. Annu Rev Cell Dev Bi 2001; 17 : 311–50. 15. Davis RL, Kirschner MW. The fate of cells in the tailbud of Xenopus laevis. Development 2000; 127 : 255–67 16. Aulehla A, Wehrle C, Brand-Saberi B, et al. Wnt3a plays a major role in the segmentation clock controlling somitogenesis. Dev Cell 2003; 4 : 395–406 17. Wedeen CJ. Regionalization and segmentation in the leech. J Neurol 1995; 27 : 277–93. 18. Shimizu T, Nakamoto A. Segmentation in annelids : cellular and molecular basis for metameric body plan. Zoo Sci 2001; 18 : 285–98 19. Gauchat D, Mazet F, Berne YC, et al. Evolution of Antp-class genes and differential expression of Hydra Hox/paraHox genes in anterior patterning. Proc Natl Acad Sci USA 2000; 97 : 4493–8. 20. Dearden PK, Akam M. Early embryo patterning in the grasshopper Schistocerca gregaria : wingless, decapentaplegic and caudal expression. Development 2001; 128 : 3435–44. 21. Chipman AD, Arthur W, Akam M. Early development and segment formation in the centipede, Strigamia maritima (Geophilomorpha). Evol Dev 2004; 6 : 78–89. 22. Marom K, Shapira E, Fainsod A. The chicken caudal genes establish an anterior-posterior gradient by partially overlapping temporal and spatial patterns of expression. Mech Develop 1997; 64 : 41–52. 23. Sommer RJ, Tautz D. Involvement of an orthologue of the Drosophila pair-rule gene hairy in segment formation of the short germ-band embryo of Tribolium (Coleoptera). Nature 1993; 361 : 448–50. 24. Tautz D. Segmentation. Dev Cell 2004; 7 : 301–12. 25. Damen WGM. Parasegmental organization of the spider embryo implies that the parasegment is an evolutionary conserved entity in arthropod embryogenesis. Development 2002; 129 : 1239–50. 26. Muller M, von Weizsacker E, Campos Ortega JA. Expression domains of a zebrafish homologue of the Drosophila pair-rule gene hairy correspond to primordia of alternating somites. Development 1996; 122 : 2071–8. 27. Prud’homme B, de Rosa R, Arendt D, et al. Arthropod-like expression patterns of engrailed and wingless in the annelid Platynereis dumerilii suggest a role in segment formation. Curr Biol 2003; 13 : 1876–81. 28. Kang D, Huang FZ, Li D, et al. A hedgehog homolog regulates gut formation in leech (Helobdella). Dev Biol 2001; 235 : 1645–57. 29. Miyawaki K, Mito T, Sarashina I, et al. Involvement of Wingless/Armadillo signaling in the posterior sequential segmentation in the cricket, Gryllus bimaculatus (Orthoptera), as revealed by RNAi analysis. Mech Develop 2004; 121 : 119–30. 30. Janssen R, Prpic NM, Damen WGM. Gene expression suggests decoupled dorsal and ventral segmentation in the millipede Glomeris marginata (Myriapoda : Diplopoda). Dev Biol 2004; 268 : 89–104. 31. Shimeld SM. The evolution of the hedgehog gene family in chordates : insights from amphioxus hedgehog. Dev Genes Evol 1999; 209 : 40–7. 32. Takatori N, Satou Y, Satoh N. Expression of hedgehog genes in Ciona intestinalis embryos. Mech Develop 2002; 116 : 235–8. 33. Irvine SQ, Martindale MQ. Expression patterns of anterior Hox genes in the polychaete Chaetopterus : correlation with morphological boundaries. Dev Biol 2000; 217 : 333–51. 34. Hemmati-Brivanlou A. Nervous system morphogenesis in vertebrates. Med Sci (Paris) 2000; 16 : 150–8. 35. Burke AC, Nelson CE, Morgan BA, Tabin C. Hox genes and the evolution of vertebrate axial morphology. Development 1995, 121 : 333–46. 36. Jiang YJ, Smithers L, Lewis J. Vertebrate segmentation : the clock is linked to Notch signalling. Curr Biol 1998; 8 : 868–71. 37. Stollewerk A, Schoppmeier M, Damen WGM. Involvement of Notch and Delta genes in spider segmentation. Nature 2003; 423 : 863–65. 38. Nulsen C, Nagy LM. The role of wingless in the development of multibranched crustacean limbs. Dev Genes Evol 1999; 209 : 340–48. 39. Rivera AS, Gonsalves FC, Song MH, et al. Characterization of Notch-class gene expression in segmentation stem cells and segment founder cells in Helobdella robusta (Lophotrochozoa; Annelida ; Clitellata ; Hirudina ; Glossiphoniidae). Evol Dev 2005; 7 : 588–99 40. Hughes NC, Jacobs DK. The end of everything : metazoan terminal addition. Evol Dev 2005; 7 : 497 41. Chen JY, Bottjer DJ, Oliveri P, et al. Small bilaterian fossils from 40 to 55 million years before the Cambrian. Science 2004; 305 : 218–22. 42. Arenas-Mena C, Cameron AR, Davidson EH. Spatial expression of Hox cluster genes in the ontogeny of a sea urchin. Development 2000; 127 : 4631–3 43. Mooi R, David B, Wray AG. Arrays in rays : terminal addition in echinoderms and its correlation with gene expression. Evol Dev 2005; 7 : 542–55 |